Uno degli obiettivi fondamentali di Romagna Acque-Società delle Fonti S.p.A. è la verifica costante della qualità dell’acqua distribuita. I controlli inerenti la qualità dell’acqua distribuita svolti dai laboratori di Romagna Acque si basano su un’accurata scelta dei punti di controllo e delle frequenze di prelievo. Queste verifiche costanti mirano ad appurare che l’acqua captata, trattata ed erogata dagli acquedotti sia salubre e conforme ai requisiti previsti dalla normativa vigente, in tema di acqua destinata al consumo umano.
La qualità ai punti di consegna
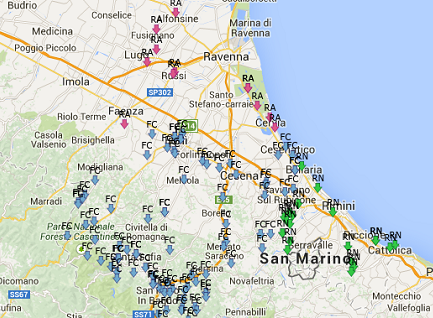
Grazie a un nuovo servizio online, è possibile visualizzare tutti i punti di consegna presenti sul territorio romagnolo, verificare l’ultima analisi eseguita dal laboratorio di Romagna Acque, e accedere allo storico di tutte le analisi eseguite sul medesimo punto di campionamento, a partire dal 2012 in poi.
Glossario dei termini utilizzati
Per orientarsi meglio nel lessico dei dati forniti, qui di seguito riportiamo un utile e completo glossario di tutti i termini utilizzati.
- Acque molto dolci: durezza compresa fra 0 e 6°F
- Acque leggere o dolci: durezza compresa fra 6 e 15°F
- Acque mediamente dure: durezza compresa fra 15 e 30°F
- Acque dure: durezza superiore a 30°F
Il servizio idrico integrato è un servizio regolato normativamente in tutto il mondo e legato alla gestione amministrativa dell’acqua. Attualmente, nel territorio romagnolo, il gestore del servizio idrico integrato è unico, ed è costituito da Hera S.p.A..
- Minimamente mineralizzate: fino a 50 mg/L
- Oligominerali o leggermente mineralizzate: fino a 500 mg/L
- Mediamente mineralizzate: fra 500 e 1500 mg/L
- Ricche di sali: oltre 1500 mg/L